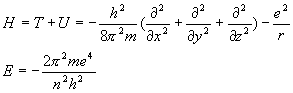
無機化学
水素原子の電子構造
Hψ=Eψ
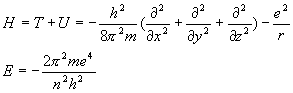
水素原子の場合はnのみに依存 → 縮退
n:主量子数 1
,2,3…l:方位量子数 0,1,2、…、(n-1)
m:磁気量子数 -l、-l+1、…、0、…、l-1、l
m
s:スピン量子数 1/2 or -1/2角運動量 L
, スピン演算子 S 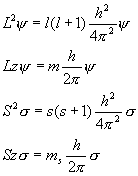
水素類似原子(
He+,Li2+)の場合 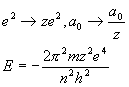
多電子原子の電子構造
ハミルトニアンに電子間クーロン反発を加える
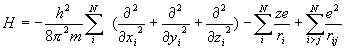
パウリの排他律:同じスピンを持つ電子は同一の軌道に入れない。
フントの規則 :軌道が縮退している場合、上向き(下向き)のスピンの電子数が最大となるように電子が占有される。
多電子原子のエネルギー項
全電子の波動関数A
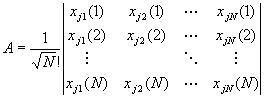
角運動量の合成
L-S結合

j-j結合
全電子波動関数Aは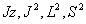 の同時固有関数。 J=L+S
の同時固有関数。 J=L+S
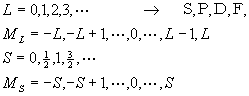
分光記号
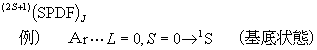
元素の周期的性質
・原子半径やイオン半径は同周期ではZが大きくなると半径が小さくなる。
(Zが大きいほど最外殻が中心に引きつけられる)
(nが大きいほど空間的に大きく広がる)
(第3遷移金属の直前に遮蔽効果の小さいランタノイドがある)
化学結合
格子エネルギー U
=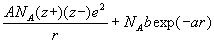
A:マデラング定数(格子構造により一定)
Er=bexp(-ar):ボルン型反発エネルギーを仮定
Uが極小になるところ→安定
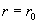 :格子定数
:格子定数
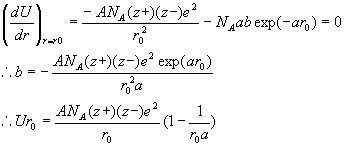
ボルン・ハーバーサイクル
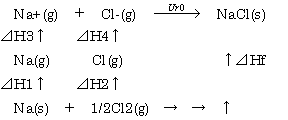
⊿
Hf=⊿H1+1/2⊿H2+⊿H3+⊿H4+Ur0高融点金属…
d軌道が共有結合 → 高融点
ミラー指数
格子の面に番号をつける。
(h,k,l)面はそれぞれx,y,z軸と
1/h,1/k,1/lで交わる面を表す。3.共有結合
VSEPR理論
分子の形を予測
反発の強さ…lp‐lp > lp‐bp > bp‐bp
酸と塩基
酸 :水溶液中でプロトンを出すもの
塩基:水溶液中で水酸化物イオンを出すもの
酸 :
塩基:
H+イオンを受け取るもの酸 :空軌道を使って電子対を受け取るもの
塩基:非共有電子対を相手の空軌道に与えるもの
HSAB(Hard&Soft Acid&Base)
硬い酸(電荷が高い、サイズ小、遷移金属ではd電子少、分極されにくい)
H+,Mg2+,Fe3+,Al3+ など
硬い塩基(電気的に陰性、分極されにくい)
F-,Cl- など
硬い酸+硬い塩基 → イオン結合的な反応
軟らかい酸(電荷が低い、サイズ大、遷移金属ではd電子多、分極されやすい)
Cu+,Ag+,Hg2+ など
軟らかい塩基(陰性度が低い、分極されやすい)
I-,CN- など
軟らかい酸 + 軟らかい塩基 → 共有結合的な物質を作る
化学平衡
G=G゜+RTlna
平衡では ‐⊿G゜=RT
lnK解離定数
KaBH+ + H2O → H3O + B
K
a=[H3O+][B]/[BH+]B + H2O → BH+ + OH-
K
b=[BH+][OH-]/[B]Ka・Kb=[H3O+][OH-]=Kw :水のイオン積 pKa+pKb=pKw=14(25℃)
酸化還元反応
酸化還元電位
Nernstの式 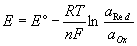
元素単体と化合物
1.水素
水素の結合様式
・イオン結合型
H3O+,ClO4-,Na+,H-・共有結合型
CH4・電子欠損型
B2H6・水素結合型
(HF)n水素吸蔵合金(
Pt,Pd,Ni)反応例
酸素:半径が大きいと過酸化物が安定
4
Li + O2 → 2LiO2
Na + O2 →Na2O2K + O2 → KO2
水素:2
M + H2 → 2MH・クラウンエーテルとの反応
(対角線関係:周期表で半径は、
Zが大きくなると小さくなり周期が下がると大きくなるため、対角線上に位置する元素の半径が近くなり性質も似かよる。Li-Mg,Be-Al,Na-Ca,K-Sr,B-Si )
反応例
CaCl2 + 2H2O → Ca(OH)2 + C2H2
5.
13族6.
14族7.
15族N2
+ 3H2 → NH3 770K,300気圧,Fe系触媒8.
16族 
9.
17族Na+Cl-
HClO(次亜塩素酸)< HClO2(亜塩素酸)< HClO3(塩素酸)< HClO4(過塩素酸)
10
.dブロック元素(*ランタノイド収縮:f電子は遮蔽効果が小さいためイオン半径が小さくなり、第
2と第3でイオン半径があまり変わらないため)11
.fブロック元素